Die Entdeckung der Behandlung von Clusterkopfschmerz mit 2-Bromo-LSD (BOL-148)
von Prof. Dr. med. Torsten Passie
Während der 1930er Jahre stellte der Schweizer Naturstoffchemiker Dr. Albert Hofmann verschiedene Mutterkornderivate für die pharmakologische Forschung der Sandoz AG in Basel her. Im Jahre 1939 synthetisierte er erstmals das Diäthylamid der Lysergsäure (LSD). Bei ersten pharmakologischen Versuchen konnten keine besonderen Eigenschaften festgestellt werden und die Substanz wanderte ungenutzt ins Regal. 1943 synthetisierte Hofmann, einer Intuition folgend, erneut LSD. Während der Synthese kam es offenbar zur Resorption einer minimalen Menge der Substanz über Hofmanns Hände. Daraufhin erlebte er den ersten LSD-Trip der Welt, mit Pseudo-Halluzinationen, intensivierten Gefühlen und verändertem Denken (Hofmann 1979). Nach Versuchen an der psychiatrischen Universitätsklinik Zürich wurde die LSD-Forschung international. Insgesamt wurden bis heute mehr als 10.000 wissenschaftliche Veröffentlichungen zu LSD gemacht (Hintzen und Passie 2010). Seine Entdeckung triggerte die Erforschung der Neurotransmitter (Green 2008).
Schon zu Beginn der LSD-Forschung realisierten die Wissenschaftler, dass es ideal wäre, wenn man eine ähnlich geartete Substanz mit etwas veränderten pharmakologischen Eigenschaften hätte, um diese vergleichend in der LSD-Forschung einzusetzen. Daher synthetisierten Hofmann und Troxler 1953 als 148tes Produkt ihrer Synthese-Reihen das Derivat 2-Bromo-LSD, welches den Codenamen BOL-148 erhielt. Es wies große Ähnlichkeit mit LSD auf, auch was die Beeinflussung des Neurotransmitter-Systems mit dem Botenstoff Serotonin angeht. Trotz dieser Ähnlichkeiten erzeugte es keine halluzinogenen Wirkungen, das heißt, das psychische und kognitive System blieben völlig unbeeinflusst. Selbst in hohen Dosierungen zeigten sich in Tierversuchen kaum Wirkungen, so dass BOL-148 als ein „LSD-Placebo“ galt und in vielen Experimenten an Tieren und Menschen eingesetzt wurde.
Neue Forschungen haben bestätigt, dass BOL-148 zwar in den Rezeptor passt, aber dort keine der LSD-typischen Folgewirkungen auslöst. Man kann sich das etwa so vorstellen, dass man ein Bremspedal tritt, aber dieses keine Verbindung zur Bremse hat.
Neben der vergleichenden Forschung zu LSD wurde BOL-148 auch für verschiedene Indikationen bei Patienten getestet. Obgleich auch Studien an Kopfschmerzpatienten durchgeführt wurden, sah man keine relevante Indikation für eine Verwendung. Allerdings prüfte das US-Militär einige Jahre lang, ob BOL-148 als Mittel zur Verhinderung von LSD-Wirkungen einsetzbar wäre. Unter der Annahme, der Rezeptor würde besetzt, so dass er auf LSD nicht mehr ansprechen würde, wurde Probanden über Tage hinweg BOL-148 gegeben und getestet, ob die LSD-Wirkungen dadurch vermindert würden oder ausblieben. Hintergrund dieser Versuche war die Befürchtung, dass LSD als chemischer Kampfstoff („Krieg ohne Tote“) eingesetzt werden könnte und man die eigenen Soldaten dagegen „immunisieren“ wollte. Die Ergebnisse waren jedoch widersprüchlich, so dass man von einer militärischen Verwendung absah.
Die Entdeckung der Behandlung von Clusterkopfschmerz mit BOL-148
Im Jahre 1995 fand ein schottischer Patient mit Clusterkopfschmerz heraus, dass die gelegentliche Einnahme von LSD periodisch auftretende Clusterkopfschmerzen verminderte. Nachdem weiteren Selbstversuchen stellte er seine Erfahrungen im Internet zur Verfügung. Daraufhin haben einige hundert Patienten die Behandlung von Clusterkopfschmerzen mit Psilocybin und LSD ausprobiert.
Nachdem die Anzahl der erfolgreichen Selbstbehandlungen größer wurde, wandte sich ein engagierter Cluster-Patient an die Harvard-Universität in Boston. Er wollte eine Studie organisieren, in der die betreffenden Patienten systematisch befragt werden. Eine solche Studie wurde von 2002-2004 durch Dr. Andrew Sewell, Prof. John Halpern und Prof. Harrison Pope in Harvard durchgeführt und 2006 in einer bedeutenden Neurologie-Zeitschrift veröffentlicht (Sewell et al. 2006). Die Ergebnisse zeigten, das LSD und Psilocybin bei Clusterkopfschmerz nicht nur die akuten Attacken unterbricht, sondern auch wochen- oder monatelange schmerzfreie Intervalle erzeugt. Später zeigte sich, dass die dreimalige Einnahme von Psilocybin oder LSD in einem Abstand von jeweils fünf Tagen zu einer erheblichen Ausdehnung der schmerzfreien Phasen („remission period“) führt (Sewell und Halpern 2007). Es war nun klar, dass Psilocybin und LSD wirksame Stoffe zur Clusterkopfschmerzes-Behandlung sind.
Um diese „anekdotischen“, lediglich auf einer Reihe von Einzelfällen basierenden Ergebnisse zu untermauern, war es erforderlich, eine klinische Studie durchzuführen. Nachdem Dr. Sewell Harvard verlassen hatte, bemühten sich Prof. Halpern und ich (in Kooperation mit Bob Wold, dem Gründer der Selbsthilfeorganisation Cluster Busters; clusterbusters.org), in Harvard eine solche durchzuführen.
Während der Jahre 2006 bis 2011 hatte ich mich als wissenschaftlicher Mitarbeiter der Medizinischen Hochschule Hannover häufiger an der Abteilung für biologische Psychiatrie des McLean Krankenhauses der Harvard Universität in Boston aufgehalten. Dort baten Prof. Halpern und ich im Jahre 2007 um ein Treffen mit der Forschungsadministration der Universität, um eine klinische Studie mit LSD vorzubereiten. Während des Gesprächs mit drei Repräsentanten der Forschungsadministration wurde deutlich, dass man seitens der Harvard-Universität erhebliche Bedenken gegen eine Studie mit einer solch heiklen Substanz wie LSD hatte. Frustriert verließen wir die Besprechung.
In den folgenden Tagen diskutierten wir die Problematik einer LSD-Studie an der Harvard-Universität. Dabei kam auch die Frage auf, inwieweit nicht-halluzinogene LSD-Derivate für die Behandlung von Clusterkopfschmerz in Frage kämen. Die Ergebnisse der oben angeführten Umfrage-Studie wiesen jedoch darauf hin, dass sub-halluzinogene Dosen nur eine deutlich geringere Wirkung besaßen. Daher vermuteten wir, dass die Verwendung eines nicht-halluzinogenen Derivates keine Wirkung haben würde.
Unsere Kenntnis der Pharmakologie von LSD und seinen Derivaten (vgl. Passie 2008, Hintzen und Passie 2010) ermöglichte es, etwa einhundert Derivate auf ihre Ähnlichkeit mit LSD (und dessen Wirkungen) durchzumustern. Am Ende rückten drei Derivate in die engere Wahl. Da die anderen beiden stärkere Nebenwirkungen hatten und etwas anders im Serotonin-System wirkten, entschieden wir uns für das nebenwirkungsarme BOL-148.
Es war nicht leicht, eine Firma zu finden, die willens und in der Lage war, dieses LSD-Derivat herzustellen. Wir mussten eine Expertise finden, wie sie nur ganz wenige Firmen hatten. Letztlich beauftragten wir die Firma THCpharm in Frankfurt/Main mit der Herstellung. Diese hatte etwa ein halbes Jahr später eine kleine Menge BOL-148 produziert, einschließlich Reinheitszertifikat.
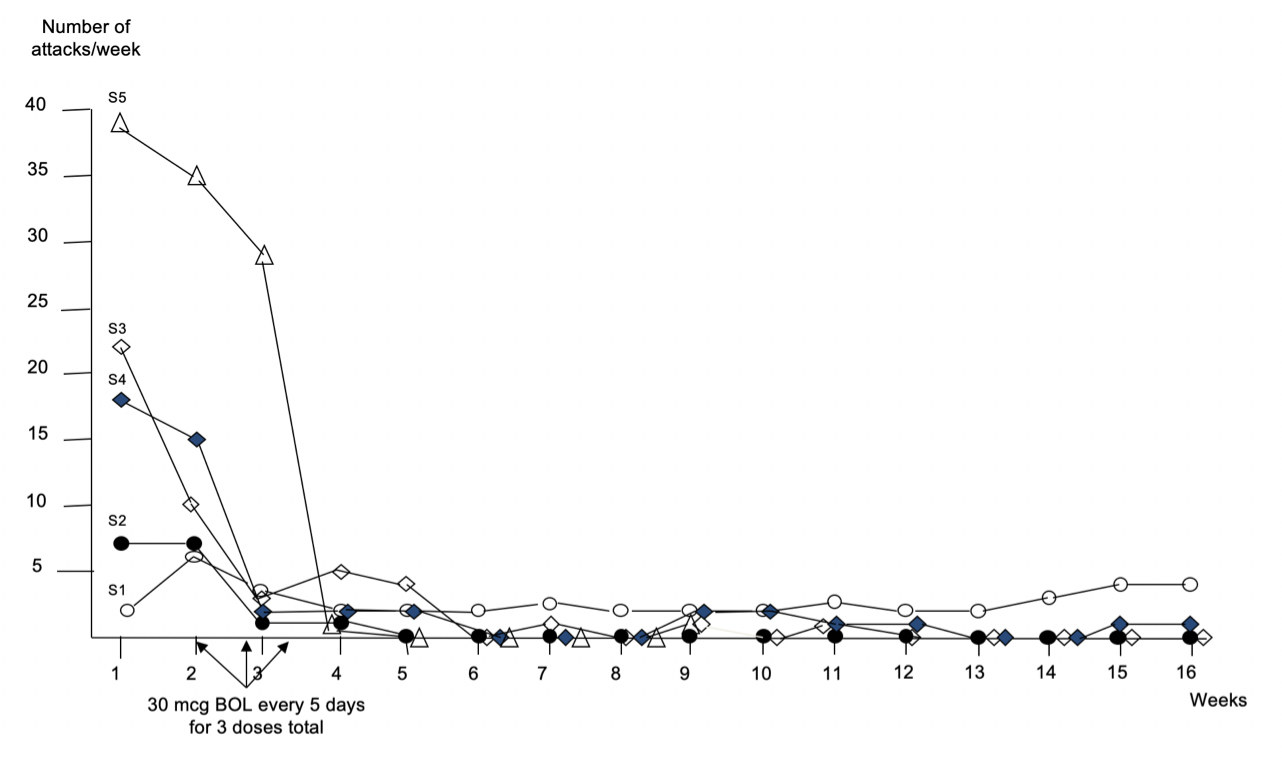
Nachdem wir die Ethikkommission der Medizinischen Hochschule Hannover über unser Vorhaben informiert hatten, suchten wir Patienten, bei denen die anderen Medikamente aus dem Repertoire der Cluster-Kopfschmerz-Behandlung versagt hatten. Diese Patienten sind zahlreich und nicht schwer zu finden. Zunächst behandelten wir drei Patienten mit BOL-148. Die eindeutigen Erfolge widersprachen unserer Erwartung, dass BOL-148 unwirksam wäre, da es ohne halluzinogene Wirkung ist. Wir hatten damals die Vorstellung, dass der Nachweis, dass nicht-halluzinogene LSD-Derivate keine Wirkung auf Clusterkopfschmerz haben, die Harvard-Administration überzeugen würde, eine Studie mit LSD zuzulassen.
Nachdem die ersten drei Patienten erfolgreich behandelt waren, bemühten sich die Universitäten um eine Patentierung der Behandlung mit BOL-148. Ein Patent wurde in den Jahren 2011-2013 zunächst in Amerika, etwas später auch international, etabliert (s. Presseerklärung; Patent EU: Patent USA). Die Ergebnisse unserer Fallserie mit fünf Patienten wurde in 2010 in der renommierten Kopfschmerz-Zeitschrift Cephalalgia publiziert (Karst et al. 2010) (Diagramm 1).